Sifat Atom
Nomor atom menunjukkan jumlah proton dalam inti atom atau banyaknya elektron pada atom netral dan diberi simbol z. Inti atom terdiri atas proton dan neutron. Oleh karena itu, massa suatu atom merupakan massa proton ditambah massa neutron. Massa ini selanjutnya disebut massa atom. Susunan suatu atom biasa ditulis dengan notasi sebagai berikut.
ZXA
Keterangan:A = nomor massa;
X = simbol atom; dan
Z = nomor atom.
Hubungan antara nomor massa dan nomor atom dapat ditulis sebagai berikut.
A = p + n
p = Z
A = Z + n
n = A – Z
Keterangan:p = jumlah proton; dan
n = jumlah netron.
Notasi ZZA dapat ditulis zXp+n. Suatu atom netral dapat memperoleh tambahan elektron atau kehilangan elektron. Atom yang mendapat tambahan elektron akan bermuatan negatif (ion negatif). Sebaliknya, atom yang kehilangan elektron akan bermuatan positif (ion positif).
2. Elektron, Proton, dan Neutron
a. Elektron
Elektron merupakan partikel atom bermuatan negatif. Elektron terletak dalam atom (terikat pada inti atom) dan menyebabkan sifat kimia. Di dalam logam, elektron bersifat bebas (tidak terikat atom) sehingga dapat menghantarkan arus listrik atau kalor. Dalam semikonduktor, aliran elektron dapat diatu sehingga dapat dibuat dioda, transistor, dan lain-lain.Nama elektron diusulkan oleh G.J Stoney. Penemuan elektron dimulai dari eksperimen yang dilakukan oleh J.J Thomson dengan tabung sinar katoda. Eksperimen ini berhasil mengukur perbandingan antara muatan listrik dengan massa sinar katoda. Menurut Thomson, sinar katoda merupakan bagian dari atom yang disebut elektron. dari hasil percobaan diperoleh em = 1,75086 x 1011 C/kg.
Selanjutnya, pada tahun 1909 ahli fisika Amerika, Robert A. Milikan berhasil mengukur muatan elektron dengan eksperimennya yang dikenal dengan percobaan tetes minyak Milikan. Dengan beberapa pengukuran, diperoleh besar muatan elektron, e = 1,6021 × 10–19 C, sedangkan massa elektron, me = 9,10908 × 10–31 kg.
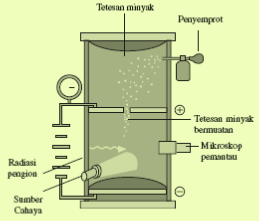
b. Proton
Pada tahun 1897, Goldstein melakukan serangkaian eksperimen dengan menggunakan tabung sinar katoda. Eksperimen tersebut dilakukan dengan cara memvariasikan katoda dari rapat ke renggang. Pada saat dibuat rapat, gas di belakang katoda tetap gelap. Akan tetapi, setelah dibuat renggang (diberi lubang), gas di belakang katoda menjadi berpijar. Hal itu menunjukkan adanya sinar yang menerobos lubang katoda sehingga gas di belakangnya menjadi berpijar. Sinar tersebut berasal dari anoda, sehingga disebut sebagai sinar anoda. Sinar anoda juga disebut sinar positif karena anoda merupakan kutub positif.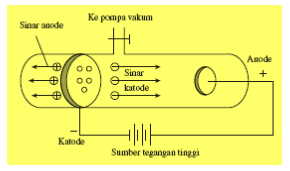
Beberapa sifat sinar anoda adalah sebagai berikut.
a. Dapat meradiasikan partikel.
b. Dapat dibelokkan medan listrik atau magnet menuju ke kutub negatif sehingga sinar anoda bermuatan positif.
c. Ukuran partikel sinar anoda bergantung pada jenis gas dalam tabung. Ukuran terkecil terjadi jika dalam tabung menggunakan gas hidrogen. Selanjutnya, partikel sinar anode itu disebut proton. Massa proton adalah 1 sma = 1,67 × 10–24 g.
d. Muatan proton adalah +1 atau 1,6 × 10–19 C. Berdasarkan hasil eksperimen, muatan dan massa partikel sinar anoda merupakan kelipatan bulat dari massa dan muatan proton. Oleh karena itu, semua partikel diasumsikan terdiri dari proton.
e. Semakin besar massa partikel, sinar anodanya semakin sukar dibelokkan.
c. Neutron
Neutron merupakan partikel dalam atom yang tidak bermuatan listrik. Neutron mempunyai massa yang dianggap sama dengan massa proton, yaitu 1,67 × 10–27 kg = 1,00890 sma (satuan massa atom). Neutron pertama kali ditemukan oleh Boseh dan Becker pada tahun 1930. Neutron dihasilkan melalui rekasi inti antara isotop berilium dan partikel alfa. Akan tetapi, penamaan istilah “neutron” dikenalkan oleh Chadwick.Neutron dalam keadaan bebas bersifat radioaktif dan dapat berubah menjadi proton dan elektron dengan waktu paruh 12 menit. Partikel ini dapat dihasilkan dalam reaktor nuklir dan alat pemercepat partikel. Walaupun tidak bermuatan, neutron memiliki momen magnetik. Oleh karena itu, neutron dapat digunakan untuk menyelidiki sifat magnetik bahan. Sementara itu, neutron yang dihasilkan reaktor nuklir dapat digunakan untuk membuat isotop radioaktif yang digunakan dalam penyelidikan struktur atom, analisis kuantitatif, dan uji tidak rusak.
3. Isotop, Isoton, dan Isobar
Atom-atom yang memiliki nomor atom sama, tetapi memiliki nomor massa berbeda disebut isotop. Berikut ini merupakan contoh isotop.a. 1H1,1H2 , 1H3 isotop dari H.
b. 17Cl35,17Cl37 isotop dari Cl.
c. 6C12,6C13,6C14 isotop dari C
Isoton adalah atom-atom yang memiliki jumlah neutron sama, tetapi nomor massanya berbeda. Berikut ini merupakan contoh isoton.
a. 23Cl38 dan 15Y30
b. 11Na23 dan 12Mg24
c. 6C13 dan 7N14
Isobar adalah atom-atom yang memiliki nomor massa sama, tetapi nomor atomnya berbeda. Berikut ini merupakan contoh isobar.
a. 13X14 dengan 11Y14
b. 27Co59 dengan 28Ni59
Thanks To : http://www.rumus-fisika.com



0 komentar:
Post a Comment